Röntgenanalyse enthüllt zentralen Schalter mit wichtiger Rolle bei Hautkrebs
Mit dem Röntgenblick von DESYs Forschungslichtquelle DORIS haben Forscher aus Hamburg und Island die Struktur eines zentralen molekularen Schalters entschlüsselt, der eine wichtige Rolle bei der gefährlichsten Form von Hautkrebs spielt, dem Melanom. Die Ergebnisse, , werfen ein neues Licht auf die Funktion des sogenannten Mikrophthalmie-assoziierten Transkriptionsfaktors MITF.
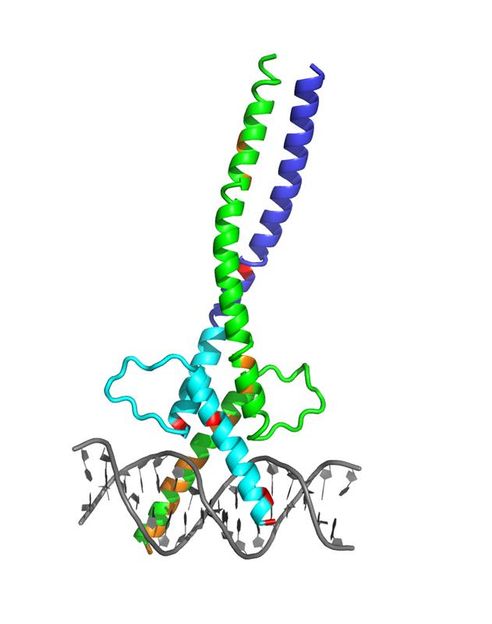
Struktur des Mikrophthalmie-assoziierten Transkriptionsfaktors MITF. Deutlich erkennbar ist der neu entdeckte Knick. Strukturelle Veränderungen durch Mutationen bei Menschen (Tietz- oder Waardenburg-Syndrom) sind rot markiert, solche bei der Maus in Orange.
Vivian Pogenberg, EMBL Hamburg

Mikroskopaufnahme der untersuchten MITF-Kristalle.
Vivian Pogenberg/EMBL Hamburg

MITF wird nicht nur mit Hautkrebs in Verbindung gebracht, sondern auch mit verschiedenen Erbkrankheiten, bei denen die Produktion des Hautpigments Melanin gestört ist. Es spielt auch eine Rolle bei manchen Aspekten des Alterns. "Unsere Ergebnisse können eine rationale Grundlage für die Entwicklung maßgeschneiderter Wirkstoffe liefern, die an MITF angreifen", erläutert Erstautor Vivian Pogenberg von der Hamburger Auβenstelle des Europäischen Laboratoriums für Molekularbiologie EMBL.
Die Forscher um Pogenberg und EMBL-Gruppenleiter Matthias Wilmanns ließen im Labor kleine Proteinkristalle aus MITF wachsen und durchleuchteten diese mit dem Röntgenlicht von DORIS. Dabei entsteht kein klassisches Röntgenbild, sondern die Kristalle streuen die Röntgenstrahlung auf charakteristische Weise. Aus dem Streubild lässt sich mathematisch die Struktur des Kristalls rekonstruieren und damit die Struktur von MITF. Die Analyse enthüllte ungewöhnliche Veränderungen in dem Molekül, die ihm einen charakteristischen Knick verleihen. MITF bildet ein Doppelmolekül (Dimer) mit langen Spiralen, die wie ein Reißverschluss ineinandergreifen. Der charakteristische Knick in diesem Reißverschluss führt dazu, dass MITF sich kaum an andere Transkriptionsfaktoren binden kann.
Die Forscher konnten auch Strukturänderungen in dem Molekül identifizieren, die auf eine Reihe von bekannten MITF-Mutationen zurückgehen, die etwa zu bestimmten Fellfarben bei Mäusen und zu Tietz- oder Waardenburg-Syndrom beim Menschen führen.
Mit den MITF-Strukturinformationen von DORIS konnten die Wissenschaftler an der Europäischen Synchrotronstrahlungsquelle ESRF im französischen Grenoble die Verbindung zwischen MITF und der DNA untersuchen. Die Analyse zeigte unter anderem Strukturänderungen durch die namensgebende Mutation, die zu weißem Fell und unnatürlich kleinen Augen (Mikrophthalmie) bei Mäusen führt. Es zeigte sich, dass diese Strukturänderungen die Bindungsstelle zwischen MITF und der DNA beeinflussen, wodurch der Transkriptionsfaktor schlechter an die DNA andockt. Andere Mutationen führen wiederum dazu, dass MITF an zu viele Gene binden kann und so an falschen Stellen andockt.
"Das Fernziel ist, die MITF-Funktionsweise komplett zu verstehen, um zu beurteilen, wie es sich für mögliche Therapien eignet", betont Wilmanns. "Ein möglicher Weg könnte beispielsweise sein, mit maßgeschneiderten Molekülen gezielt die Dimerisierung von MITF in Melanozyten zu stoppen", erläutert Pogenberg. "Alternativ könnte ein anderes passgenaues Molekül den Transkriptionsfaktor daran hindern, die Bindestelle im Erbgut zu erkennen."
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
STED-Höchstauflösungsmikroskop von Leica Microsystems abermals ausgezeichnet - Leica TCS SP8 STED 3X gewinnt den Top 10 Innovations Award der Zeitschrift The Scientist
Kryo-Kraftspektroskopie zeigt mechanische Eigenschaften von DNA-Bauteilen auf
Neue Bilder aus der Nanowelt: Direkte Beobachtung der Bindung von Kohlenmonoxid
























































