Eine halbe Nadel im Heuhaufen
Methode zur Spurenanalytik von niedermolekularen Verbindungen
Russische Forscher vom Prokhorov General Physics Institute der Russischen Akademie der Wissenschaften (GPI RAS) und dem Moskauer Institut für Physik und Technologie (MIPT) haben die weltweit erste ultrasensitive Methode zur schnellen Erkennung kleiner Moleküle entwickelt. Diese Methode erkennt Spuren von Toxinen, Hormonen, Vitaminen und anderen biologisch aktiven Molekülen, die unter anderem für das Gesundheitswesen und die Überwachung der Lebensmittelsicherheit von Bedeutung sind.
Eine halbe Nadel im Heuhaufen
Lion_on_helium/MIPT Press Office
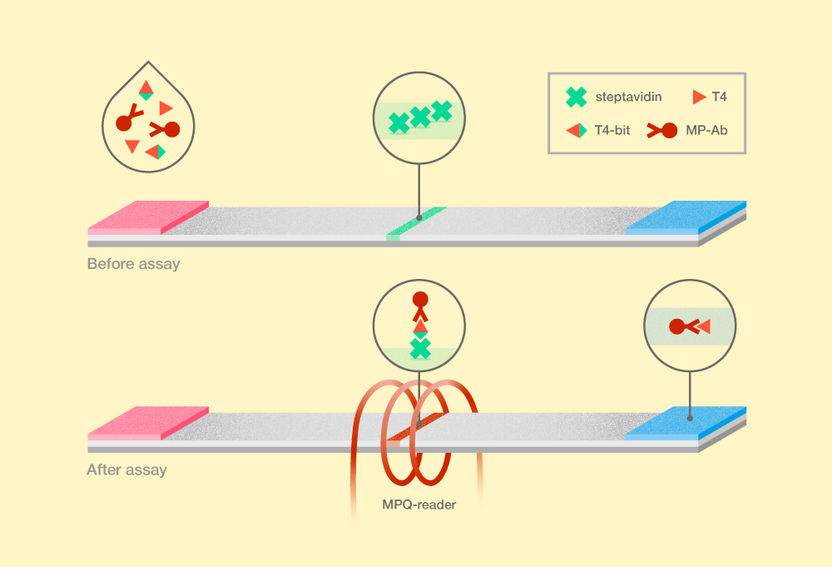
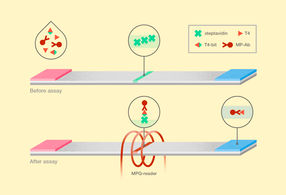
Neue Methode zum Nachweis von Thyroxin. T4 steht für Thyroxin, T4-Bit ist der bifunktionelle Ligand von Thyroxin und Biotin, und MP-Ab steht für Anti-Thyroxin-Antikörper, die mit magnetischen Nanopartikeln markiert sind.
Lion_on_helium/MIPT Press Office
Der neue Lateral-Flow-Assay basiert auf magnetischen Labeln und dauert weniger als 30 Minuten. Er ist 100-mal empfindlicher als ELISA, der für konventionelle Labortests verwendet wird. Die Autoren zeigten die Wirksamkeit des neuen Ansatzes an einem Modellassay zur Messung von Thyroxin im menschlichen Blutserum. Thyroxin ist eines der wichtigsten Hormone der Schilddrüse und kann zur Überwachung ihrer Funktion herangezogen werden. Das Assayverfahren ist erschwinglich und einfach genug, um am Ort der Behandlung, direkt nach der Blutabnahme, durchgeführt zu werden.
Der Grund dafür, dass man niedermolekulare Verbindungen mit hoher Empfindlichkeit nachweisen muss, ist, dass sie oft schon in kleinen Konzentrationen eine starke Wirkung auf den Körper haben. Derzeit gilt ELISA als der Goldstandard zur Messung der Konzentration kleiner Moleküle. Diese Methode erfordert jedoch ausreichend ausgestattete Labors mit hoch qualifiziertem Personal für die Umsetzung. Die Empfindlichkeit des Nachweises von Schilddrüsenhormonen kann durch Radioimmunoassays mit radioaktiven Markierungen erhöht werden, die kurze Halbwertszeiten haben und potenziell gefährlich sind. Andere konventionelle Analysen erfordern eine lange Probenvorbereitung und spezielle Geräte.
Der Lateral-Flow-Assay (LFA), der vor allem für seine Anwendung in Schwangerschaftstests bekannt ist, stellt eine attraktive Alternative dar. Im Vergleich zu ELISA ist es weniger aufwändig und technisch nicht komplex. In vielen Ländern verfügt sie jedoch nur über eine behördliche Zulassung für das Erreichen von Schwellenwerten und nur für die Fälle, für die eine hohe Sensitivität nicht erforderlich ist. Daher ist es ein vorrangiges Ziel der medizinischen Diagnostik, eine Methode zur Erkennung kleiner Moleküle zu entwickeln, die schnell, empfindlich und einfach ist.
Ein gemeinsames Forschungsteam von GPI RAS und MIPT einen Assay-Kit entwickelt, der ein modifiziertes LFA mit magnetischen Nanomarken und bifunktionellen Liganden verwendet. Um die Fähigkeiten und Grenzen des neuen Systems zu testen, wählten die Autoren den Nachweis von Thyroxin, dem wichtigsten Schilddrüsenhormon, als Modell. Darüber hinaus hat es ihrer Forschung klinische Bedeutung verliehen.
Der Aufbau des neuen magnetischen Immunoassays unterscheidet sich in mehrfacher Hinsicht vom konventionellen LFA. Das Blutserum eines Patienten, das auf freies Thyroxin getestet wird, wird gleichzeitig mit magnetischen, mit Nanopartikeln markierten Antikörpern und mit einem bifunktionellen Thyroxinliganden ergänzt. Bei diesem bifunktionellen Liganden handelt es sich um ein Thyroxin, das über eine "Brücke" kovalent an Biotin gebunden ist, die die beiden Moleküle verbindet, sie aber auch voneinander trennt. Die Antikörper auf magnetischen Nanopartikeln können so sowohl an Thyroxin aus dem Blutserum als auch an den bifunktionellen Liganden binden. Nach einer gewissen Zeit, die so bemessen ist, dass die Moleküle in der Lösung aneinander binden, wird das Gemisch auf einer Membran abgeschieden. An den bifunktionellen Liganden gebundene Partikel werden an der Testlinie von Streptavidin gebunden, einem Protein mit einer außergewöhnlich hohen Affinität zu Biotin. Um die Untersuchungsergebnisse abzurufen, verwendeten die Forscher Geräte, die die ultrasensitive Magnetpulverquantifizierungsmethode MPQ verwenden. Es handelt sich um eine nichtlineare Ummagnetisierung von Partikeln durch ein magnetisches Wechselfeld bei zwei Frequenzen und eine anschließende Erfassung der induktiven Reaktion bei kombinatorischen Frequenzen. Die hohe Affinität des bifunktionellen Liganden zum Teststreifen gewährleistet zusammen mit der Genauigkeit der MPQ-Methode eine beispiellose Sensitivität des Assays, die eine Nachweisgrenze von etwa 1 Million Molekülen des Hormons pro Milliliter (16 Femtogramm) mit einem dynamischen Bereich von drei Größenordnungen erreicht
Dr. Petr Nikitin, der das Forschungsteam leitete, gab weitere Details über die Studie bekannt: "Unsere Methoden zur Messung der Konzentration von niedermolekularen Verbindungen werden über universelle immunochromatographische Streifen mit Streptavidin auf der Nachweislinie durchgeführt. So sind sie leicht zu replizieren und zu vergrößern. Um Tests für andere Analyten zu entwickeln, bräuchten wir Standardantikörper und spezielle bifunktionelle Liganden, deren Synthese für kleine Moleküle eine Herausforderung darstellt."
"Glücklicherweise beinhaltet unser Toolkit originale interferometrische Techniken und Geräte, die wir zuvor entwickelt haben und die eine Echtzeit-Detektion der molekularen Interaktionsdynamik ermöglichen", erklärte Petr Nikitin, MIPT-Absolvent von 1979 und Laborleiter bei GPI RAS. "Wir haben mit dieser Ausrüstung die optimalen Immunreaktanten und die bifunktionellen Thyroxin-Biotin-Liganden identifiziert, die aufgrund ihrer beabstandeten, "überbrückten" Struktur beide kleinen Moleküle für eine effektive Interaktion mit beiden großen Molekülen zur Verfügung stellen - nämlich mit dem Nachweisantikörper und Streptavidin. Es hat uns viel Zeit für die Testentwicklung gespart und wesentlich zum Erfolg dieser Forschung beigetragen."
Der Hauptautor der Arbeit, Dr. Alexey Orlov, ein Forscher bei GPI RAS und dem Nanobiotechnology Lab des MIPT, fügte hinzu: "Wir verwenden magnetische Partikel als Nanomarker von immunochemischen Reaktionen. Eine tragbare Vorrichtung erfasst diese Partikel quantitativ mit höchster Präzision aus dem gesamten Volumen der 3D-Reaktionszone auf einem Teststreifen und nicht von der Oberfläche einer Membran, wie es bei optischen Labels der Fall ist. Dies ist einer der Faktoren, die die Einfachheit unserer Messungen kleiner Moleküle in komplexen Medien mit extrem niedriger Konzentration gewährleisten. Infolgedessen ist praktisch jeder in der Lage, einzigartig empfindliche Assays ohne aufwändige Probenvorbereitung durchzuführen."
"Der neue Assay ist eine Point-of-Care-Testtechnik, deren Eigenschaften die bestehenden Systeme für die Labordiagnostik deutlich übertreffen", sagt Sergey Znoyko, PhD, Erstautor des Papiers. "Durch die Erweiterung des Spektrums der auf diese Weise nachweisbaren biologischen Moleküle könnten wir in Zukunft einen Multiparameter-Test für komplexe Medien wie Blut durchführen, der viel billiger wäre als die derzeitigen Analoga".
"Dieser Ansatz ist einfach, erschwinglich und anpassungsfähig für den Nachweis anderer kleiner Moleküle", sagt die MIPT-Studentin Natalia Guteneva, die die Studie mitverfasst hat. "Wir hoffen, dass es aktiv für die Suche nach neuen Krankheitsmarkern, in der medizinischen Diagnostik, der ökologischen Überwachung, der Lebensmittelsicherheitskontrolle, der Biosicherheit und anderswo genutzt wird."
Originalveröffentlichung
Sergey L. Znoyko and Alexey V. Orlov and Averyan V. Pushkarev and Elizaveta N. Mochalova and Natalia V. Guteneva and Afanasy V. Lunin and Maxim P. Nikitin and Petr I. Nikitin; "Ultrasensitive quantitative detection of small molecules with rapid lateral-flow assay based on high-affinity bifunctional ligand and magnetic nanolabels"; Analytica Chimica Acta; 2018
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.
Themenwelt Antikörper
Antikörper sind spezialisierte Moleküle unseres Immunsystems, die gezielt Krankheitserreger oder körperfremde Substanzen erkennen und neutralisieren können. Die Antikörperforschung in Biotech und Pharma hat dieses natürliche Abwehrpotenzial erkannt und arbeitet intensiv daran, es therapeutisch nutzbar zu machen. Von monoklonalen Antikörpern, die gegen Krebs oder Autoimmunerkrankungen eingesetzt werden, bis hin zu Antikörper-Drug-Konjugaten, die Medikamente gezielt zu Krankheitszellen transportieren – die Möglichkeiten sind enorm.