Parkinson auf der Spur
Chemiker weisen Folgen von punktuellen Mutationen des Proteins Alpha-Synuclein nach
Um Krankheiten wie Parkinson bekämpfen zu können, müssen ihre molekularen Ursachen verstanden sein. Chemikern der Universität Konstanz um Prof. Dr. Malte Drescher gelang es jüngst, die Konsequenzen zu analysieren, die von einer punktuellen Mutation des Proteins alpha-Synuclein ausgehen – einem Protein, das eng mit der Parkinson-Krankheit verknüpft ist.
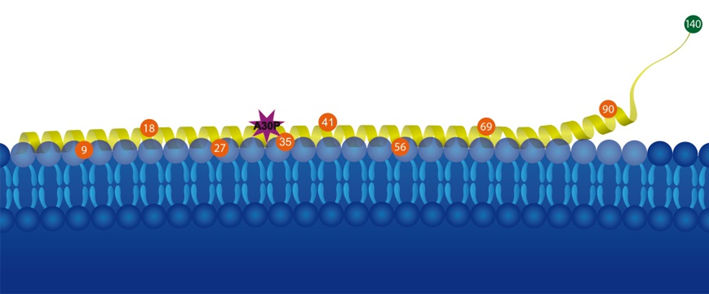
Anbindung des Proteins Alpha-Synuclein (gelb) an Lipid-Membranen (blau). Um den Einfluss einer punktuellen Mutation der 30. Aminosäure (A30P) von Alpha-Synuclein zu untersuchen, brachte Malte Dreschers Forschungsgruppe magnetische Sonden (siehe nummerierte Kreise) an das Protein an.
Universität Konstanz
In einer aufwändigen Versuchsreihe analysierten sie, welche Folgen die Änderung einer einzigen Aminosäure des Proteins hat. Die Physikochemiker konnten nachweisen, wie diese winzige Veränderung die Anbindung von Alpha-Synuclein an Membranen stört. „Wir hoffen, dass die Erkenntnis der punktuell gestörten Membranbindung hilft, die Entstehung von Parkinson auf molekularer Ebene zu verstehen. Letztlich wird das ermöglichen, therapeutische Strategien zu entwickeln“, schildert Julia Cattani, die als Doktorandin maßgeblich an dem Forschungserfolg beteiligt war.
Das menschliche Gehirn enthält große Mengen des kleinen Proteins Alpha-Synuclein. Seine exakte biologische Funktion ist noch unbekannt, allerdings ist es eng mit der Parkinson-Krankheit verknüpft: Bei Parkinson-Patienten „verklumpt“ das Protein in den Nervenzellen. Alpha-Synuclein besteht aus einer Kette von 140 Aminosäuren. In seltenen Fällen kann die Parkinson-Krankheit vererbt werden, in diesen Fällen ist bei den Betroffenen einer dieser 140 Bausteine ausgetauscht. Malte Drescher und seine Arbeitsgruppe am Fachbereich Chemie der Universität Konstanz haben nun herausgefunden, welchen Einfluss diese punktuellen Änderungen in der Proteinsequenz auf das Verhalten von Alpha-Synuclein haben. „Wir können zeigen, dass die Punktmutationen lokal die Membranbindung von Alpha-Synuclein stören“, sagt Malte Drescher.
Um dem Einfluss der punktuellen Mutationen auf die Spur zu kommen, brachten die Konstanzer Chemikerinnen Dr. Marta Robotta und Julia Cattani winzige magnetische Sondenmoleküle an verschiedenen Stellen des Proteins Alpha-Synuclein an. Mit Hilfe der Elektronenparamagnetischen Resonanzspektroskopie – einem Verfahren, das methodisch an die aus der Medizin bekannte Kernspintomographie angelehnt ist – konnten die Forscherinnen die Rotation dieser Nanomagnete messen. An jeder Stelle, an der Alpha-Synuclein an eine Membran bindet, verlangsamt sich die Rotation. Auf diese Weise konnte punktgenau ermittelt werden, wann und wo eine Anbindung an Membranen stattfindet – und wann nicht. Für den Fall der ausgetauschten Aminosäure stellten die Konstanzer Biochemiker eine Hemmung der Membranbindung von Alpha-Synuclein fest – ein wichtiges Indiz für die molekularen Zusammenhänge hinter der Parkinson-Krankheit.
„Der Aufwand war riesig. Wir haben über 200 spektroskopische Experimente durchgeführt, deren Ergebnisse wir durch einen speziell entwickelten Simulationsalgorithmus mit unseren Modellen verglichen haben. Aber das Ergebnis entschädigt für die Mühen“, so Julia Cattani. Projektleiter Malte Drescher sieht neben dem großen Engagement seiner Mitarbeiterinnen vor allem das Umfeld des Sonderforschungsbereichs (SFB) 969 „Chemische und biologische Prinzipien der zellulären Proteostase“, in dessen Rahmen das Projekt gefördert wurde, als wichtige Voraussetzung für die gelungene Forschungsarbeit: „Die interdisziplinäre Vernetzung und die Diskussionen mit den Kollegen haben uns bei vielen Problemen, die es zu lösen galt, weitergeholfen“, unterstreicht Malte Drescher.
Originalveröffentlichung
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!