Forscher berechnen zentrale Eigenschaft von Wasser
Wasser-Moleküle können spontan in negativ und positiv geladene Teilchen zerfallen. Chemiker der Universitäten Bonn, Rostock und Wisconsin-Madison haben diese Eigenschaft erstmals am Computer nachvollzogen. Ihre Studie wirft Licht auf eine Reaktion, ohne die es vermutlich kein Leben gäbe.
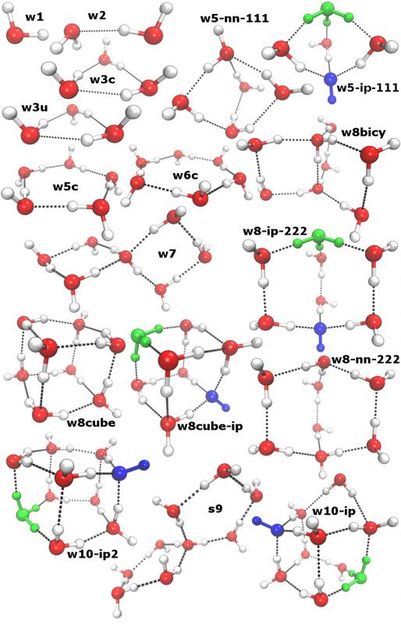
Verschiedene Cluster von Wassermolekülen: Manche sind dazu in der Lage, negativ geladene Hydroxid-Ionen (blau) und positiv geladene Hydronium-Ionen (grün) zu stabilisieren.
© AG Kirchner/Uni Bonn
Flüssiges Wasser besteht zum überwiegenden Teil aus neutralen H2O-Molekülen. Diese können jedoch spontan zerfallen. Dabei entstehen ein negativ geladenes Hydroxid-Ion sowie ein positiv geladenes Hydronium-Ion. Diese Reaktion ist ausgesprochen selten: Auf zehn Milliarden Wassermoleküle kommen nur 36 Ionen.
So verschwindend klein diese Zahl ist: Theoretisch müsste sie noch viel niedriger sein. Die Bindungskräfte innerhalb des Wassermoleküls sind so stark, dass ein spontaner Zerfall extrem unwahrscheinlich ist. Auch tendieren die Ionen dazu, sich direkt wieder zu verbinden. In flüssigem Wasser laufen jedoch Prozesse ab, die seine „Eigendissoziation“ (so das Fachwort für dieses Phänomen) fördern.
„Bei der Quantifizierung dieser Prozesse tappten die Chemiker aber bislang im Dunkeln“, erklärt Dr. Eva Perlt vom Institut für Physikalische und Theoretische Chemie der Universität Bonn. „Dabei bildet die Eigendissoziation die Grundlage für viele Säure-Base-Reaktionen – also für alles, was mit dem pH-Wert zusammen hängt.“ Ohne diese zentrale Eigenschaft wäre Leben, wie wir es kennen, wohl nicht denkbar.
Klassische Simulation am Rechner zu aufwändig
Theoretische Chemiker nutzen heute Computermodelle, um bestimmte Reaktionen besser zu verstehen. Der Zerfall der Wassermoleküle entzieht sich jedoch klassischen Simulationen. „Da die Eigendissoziation so selten ist, müssten wir dazu im Rechner viele Milliarden Teilchen simulieren“, erklärt Perlt. „Das übersteigt schlicht die Leistung der heute verfügbaren Hardware.“
Das internationale Forscherteam hat daher einen anderen Weg beschritten. Wassermoleküle sind polar; sie haben wie kleine Magneten gewissermaßen einen Nord- und einen Südpol. In Lösung ordnen sie sich daher zu lockeren räumlichen Strukturen an, so genannten Clustern. Manche dieser Cluster bieten ein Milieu, in dem sich Ionen besonders wohl fühlen. Sie schaffen also eine Art Mikroumgebung, die die Eigendissoziation fördert.
„Wir haben nun in unserem Modell berechnet, welche Arten von Clustern in flüssigem Wasser vorliegen“, erklärt Prof. Dr. Barbara Kirchner, Leiterin des „Mulliken Center for Theoretical Chemistry“ an der Universität Bonn. „Dadurch konnten wir die Komplexität des Modells erheblich reduzieren. Aus der Zusammensetzung der Cluster konnten wir dann auf die Wahrscheinlichkeit schließen, mit der die Wassermoleküle dissoziieren.“
Das Ergebnis der Berechnung deckt sich hervorragend mit den Werten, die sich in der Natur beobachten lassen. Dem transatlantischen Forscherteam gelang es auch, die Temperaturabhängigkeit des Zerfalls nachzuvollziehen. „Zwischen dem Schmelz- und dem Siedepunkt des Wassers nimmt die Selbstdissoziation um etwa den Faktor 1000 zu“, erläutert Prof. Dr. Ralf Ludwig von der Universität Rostock. „Diese Zunahme wird auch von unserer Computersimulation vorhergesagt.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.