Schärfstes Bild von Alzheimer-Fibrillen zeigt bislang unbekannte Details
Ein deutsch-niederländisches Forscherteam hat die Struktur einer Amyloid-Fibrille in bislang unerreichter Auflösung entschlüsselt. Fasern aus dem körpereigenen Protein Amyloid-beta (Aß) sind der Hauptbestandteil krankhafter Eiweißablagerungen im Gehirn. Diese gelten als zentrales Kennzeichen der Alzheimerschen Demenz. Das atomgenaue Modell der Wissenschaftler des Forschungszentrums Jülich, der Heinrich-Heine-Universität Düsseldorf, des Hamburger Centre for Structural Systems Biology sowie der Universität Maastricht zeigt bislang unbekannte strukturelle Details, mit denen sich viele Fragen zum Wachstum der schädlichen Ablagerungen sowie zur Wirkung genetischer Risikofaktoren erklären lassen.
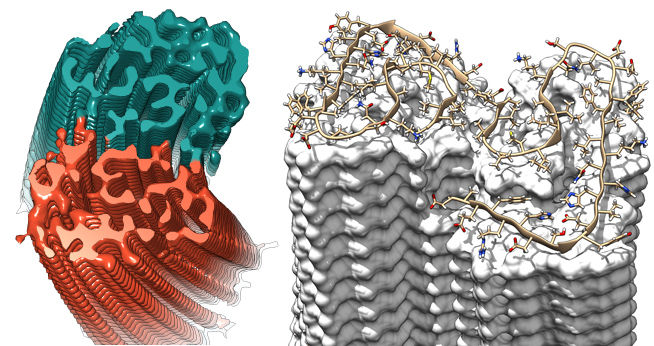
Querschnitt durch die Fibrille, in dem die stufenweise überlappende Anordnung der Aβ-Proteine deutlich wird.
Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder

3D-Rekonstruktion einer Amyloid-Fibrille aus zwei Protofilamenten (rot/grün), die aus Kryo-Elektronenmikroskopie-Aufnahmen errechnet wurde
Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
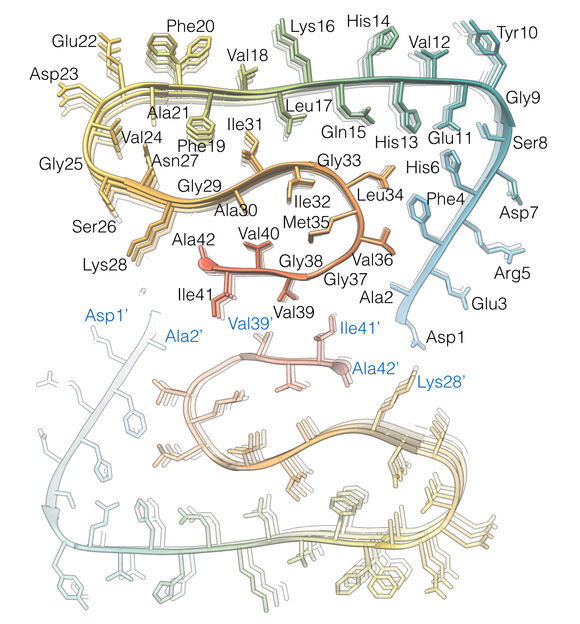
Bestimmung der 42 Aminosäuren, aus denen jedes Aβ-Molekül besteht
Copyright: Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
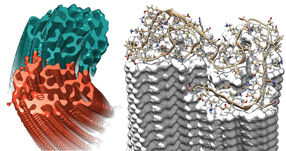

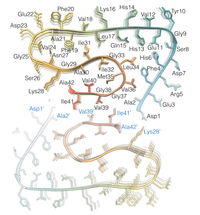
Die mittels Kryo-Elektronenmikroskopie gewonnene Struktur zeigt, wie sich die scheibchenweise übereinanderliegenden Eiweißbausteine, Aβ-Proteine, zu Fasern anordnen, die auch als "Protofilamente" bezeichnet werden. Je zwei dieser sich umeinander drehenden Protofilamente bilden gemeinsam eine Fibrille aus. Wenn sich mehrere dieser Fibrillen miteinander verknäueln, entstehen die typischen Ablagerungen oder "Plaques", wie sie sich im Gehirngewebe von Alzheimer-Patienten nachweisen lassen.
„Dies ist ein Meilenstein auf dem Weg zu einem grundlegenden Verständnis amyloider Strukturen und den damit zusammenhängenden Krankheiten“, erläutert Prof. Dieter Willbold, Institutsleiter am Forschungszentrum Jülich und der Heinrich-Heine-Universität Düsseldorf. „Die Fibrillenstruktur erklärt mit einem Schlag viele Fragen zum Mechanismus des Fibrillenwachstums und die Rolle einer ganzen Reihe von genetischen Faktoren bei der Entstehung von Alzheimer“, so Willbold.
Die erzielte Auflösung von 4 Angström, das entspricht 0,4 Nanometer, liegt im Bereich der typischen Größenordnung von Atomradien und Atombindungslängen. Das Modell zeigt anders als bisherige Arbeiten erstmals die genaue Lage und die Wechselwirkungen der Proteine untereinander. Die Aß-Moleküle der umeinander gewundenen Protofilamente liegen sich demnach nicht genau auf gleicher Höhe gegenüber, sondern sind wie bei einem Reißverschluss um einen halben Abstand übereinander versetzt. Zudem lassen sich in dem Modell erstmals alle 42 Aminosäurereste identifizieren, aus denen jedes einzelne Aß-Protein besteht.
Damit gibt es nun eine neue Basis, den strukturellen Effekt einer Reihe von genetischen Veränderungen zu verstehen, die das Krankheitsrisiko erhöhen: Sie stabilisieren die Fibrillen – wie man jetzt sehen kann – durch Änderungen im Bauplan des Proteins an definierten Stellen. Umgekehrt erklärt sich auch, warum Mäuse in der Natur kein Alzheimer bekommen oder eine kleine isländische Bevölkerungsgruppe beinahe resistent gegen die Krankheit zu sein scheint: Ihre Varianten des Proteins unterscheiden sich in einer oder mehreren Aminosäuren, die für den Zusammenhalt der Fibrillen anscheinend maßgeblich von Bedeutung sind.
Methodische Vielfalt auf höchstem technischen Niveau
Anders als die krankheitstypischen Plaques, die Alois Alzheimer vor über 100 Jahren entdeckte, ließ sich die nun ermittelte Struktur der Fibrillen nicht direkt unter dem Mikroskop beobachten. Über ein Jahr dauerte die Analyse der Daten, die die Forscher mittels Kryo-Elektronenmikroskopie an der Universität Maastricht gewonnen hatten. Zudem trugen Messungen mittels Festkörper-Kernresonanz-Spektroskopie und Röntgendiffraktions-Experimente dazu bei, das Bild der Fibrillenstruktur zu vervollständigen und die gewonnenen Daten zu validieren.
„Die einzelnen Aufnahmen in der Kryo-Elektronenmikroskopie sind meistens extrem verrauscht, weil Proteine sehr empfindlich gegenüber Elektronenstrahlung sind und die Bilder nur mit einer geringen Strahlungsintensität erzeugt werden können“, erklärt Jun.-Prof. Gunnar Schröder vom Forschungszentrum Jülich und der Heinrich-Heine-Universität Düsseldorf. Mithilfe eines computergestützten Verfahrens hatte er Tausende Einzelbilder kombiniert und so die hochaufgelösten Strukturdaten aus den Aufnahmen extrahiert.
„Das ist ein Schritt, der sehr kompliziert sein kann, wenn die Probe heterogen ist, also aus vielen unterschiedlich geformten Fibrillen besteht. Bei den Amyloid-Fibrillen war das bisher fast immer der Fall und stellte eines der wesentlichen Hindernisse für die Analyse dar. Aber nun hatten wir eine ziemlich einzigartige Probe mit sehr homogenen Fibrillen – 90 Prozent hatten die gleiche Länge und Symmetrie“, so Schröder.
Die Herstellung der Probe war Dr. Lothar Gremer vom Forschungszentrum Jülich und der Heinrich-Heine-Universität Düsseldorf geglückt. „Entscheidend war es, das Wachstum der Fibrillen in der Probe sehr stark zu verlangsamen, von einigen Stunden auf mehrere Wochen. Dadurch hatten die Aß-Einzelmoleküle genügend Zeit, sich sehr gleichmäßig und hochgeordnet zu homogenen Fibrillen anzuordnen“, so Gremer, der die Studie initiiert und koordiniert hat.
Untersuchungen der Probe mittels Festkörper-NMR-Spektroskopie lieferten zusätzliche Daten für das Erstellen des Modells und halfen dabei, die Richtigkeit der ermittelten Struktur zu überprüfen. „Mit NMR konnten wir weitere Dinge erkennen, zum Beispiel welche Aminosäurereste Salzbrücken bilden, die der Fibrille Festigkeit geben“, erklärt Prof. Henrike Heise von der Heinrich-Heine-Universität Düsseldorf und dem Jülicher Biomolekularen NMR-Zentrum. Röntgendiffraktions-Experimente unter Leitung von Prof. Jörg Labahn am Hamburger Centre for Structural Systems Biology bestätigten die Ergebnisse zusätzlich.
Originalveröffentlichung
"Fibril structure of amyloid-ß(1-42) by cryo-electron microscopy"; Lothar Gremer, Daniel Schölzel, Carla Schenk, Elke Reinartz, Jörg Labahn, Raimond Ravelli, Markus Tusche, Carmen Lopez-Iglesias, Wolfgang Hoyer, Henrike Heise, Dieter Willbold, Gunnar F. Schröder; Science; published 7 September 2017