Von Colibri, Bad Guys und Bruchpiloten
Das diesjährige Forum Mikroskopietrends'07 in Wetzlar präsentierte neben innovativen Licht- und Gerätekonzepten Forschungserkenntnisse direkt aus den Anwenderlaboren. Dr. Wolf-Otto Reuter, Vorsitzender der Geschäftsführung der Leica Microsystems GmbH, hieß die Besucher in Wetzlar willkommen und lud im Anschluss an das Forum zu einer Besichtigung der Mikroskopsystem-integration und der Objektivfertigung im Stammwerk des Unternehmens Leica Microsystems ein.
Langfristiges Ziel aller Entwicklungsbemühungen ist es, die unterschiedlichsten, dynamischen Bioprozesse quasi per optischem Zoom in molekularer Auflösung quantitativ zu visualisieren. Im Fokus des Programms standen immer wieder neue Ansätze, die die schädigenden Effekte der Mikroskopie wie Bleaching oder Fototoxizität reduzieren helfen, um die in vivo-Proben zu schonen. Dieses Ziel verfolgt auch COLIBRI, eine auf LED-Basis entwickelte neuartige Lichtquelle von Carl Zeiss, die optimale Eigenschaften für die Fluoreszenzmikroskopie verspricht: Aufgrund des schmalen Farbbereiches einer LED müssen IR- und UV-Strahlen nicht mehr aufwändig herausgefiltert werden. Sie verursacht weder Streulicht noch Fading-Effekte, und zeichnet sich durch ein sehr gutes Signal zu Rauschverhältnis sowie eine geringe Fototoxizität aus. Imagingspezialist Hubert Bauch sieht wichtige Vorteile für das Life Cell Imaging in der sehr kurzen Schaltdauer von unter 1 ms, mit der kein existierender Shutter konkurrieren kann, und der vielfältigen Kombinierbarkeit unterschiedlicher Anregungswellenlängen bei Verwendung mehrerer Fluoreszenzfarbstoffe in einem Präparat.
Leica Microsystems präsentierte Neuigkeiten aus dem Bereich von TIRF. Diese bereits 1983 von Professor Axelrod entwickelte Methode zur Hochauflösung in Z-Achse beruht auf der Reflektion an Grenzflächen und eignet sich vor allem für Beobachtungen von Membranvorgängen lebender Zellen, da die Eindringtiefe je nach eingesetzter Wellenlänge auf maximal 300 nm beschränkt bleibt. In diesem Bereich allerdings erreicht TIRF fünffach erhöhte Auflösung ohne störende Hintergrundsignale, verbunden mit sehr geringem Bleachen und praktisch ohne Fototoxizität. Für eine umfassende Nutzbarkeit dieser interessanten Methode hat Leica inzwischen ein vollautomatisches Mikroskop auf den Markt gebracht. Für die Zukunft erwartet Produktmanager Christian May eine verstärkte Kombination von TIRF mit dem so genannten FRET-Verfahren (Fluoreszenz-Resonanz-Energie-Transfer).
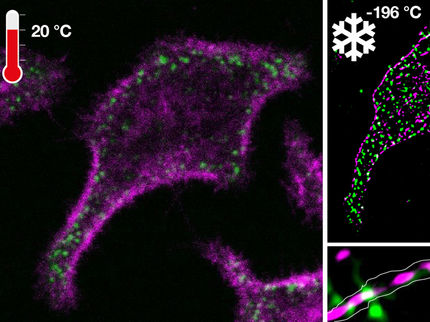
Das seit vergangenem Jahr erstmals kommerziell erhältliche Mikroskop mit dem vielfach ausgezeichneten STED-Verfahren wird am Bio-Imaging Center Würzburg zur Untersuchung von Vorgängen an chemischen Synapsen eingesetzt. Dabei hat man vor allem das Protein Bruchpilot im Visier, das vermehrt in den Vesikeln der aktiven Zone vorkommt. Die Anwendung von STED dient z.B. dem Beleg der Hypothese, dass eine Bruchpilot-abhängige Matrix an der aktiven Zone benötigt wird, um Ca2+ Kanäle ordnungsgemäß anzuhäufen. Kürzlich erst konnten die Würzburger Forscher mit Hilfe von STED nachweisen, dass das Protein Liprin sich eng um Bruchpilot in der aktiven Zone lagert und hier eine wichtige Rolle bei der Bildung neuer Synapsen spielt.
Professor Vonesch, Leiter des von ihm vor 16 Jahren gegründeten Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC) in Straßburg, stellte die Erfahrungen mit dem vor sieben Jahren am Institut entwickelten "MakroFluo" vor. Die Technik kombiniert eine hohe Auflösung mit Großfeldaufnahmen und ermöglicht schonende Aufnahmen am lebenden Objekt - vom Gesamtbild bis hin zur Darstellung weniger Zellen. Der Prototyp war noch aus Holz gefertigt - vor drei Jahren führte Leica das TCS LSI am Markt ein. Seitdem wird es am IGMBC erfolgreich für Untersuchungen von Arteriosklerose bei Mäusen oder der Entstehung von Thrombose eingesetzt.
Ein weiteres Verfahren für die schonende Lebendzellbeobachtung wurde von Marco Marcello vom Deutschen Krebsforschungszentrum Heidelberg vorgestellt. Er entwickelte gemeinsam mit der Gruppe von Ernst Stelzer (EMBL) das Selective Plane Illumination Microscopy (SPIM) zur Beobachtung 3-dimensionaler Zellkulturen. Diese 3D-Formationen bilden sehr viel genauer die Bedingungen in realen Zellen ab und eignen sich daher besser als Forschungsobjekte z.B. für die Entwicklung neuer Medikamente. Marcello stellte eine vergleichende Studie von SPIM mit anderen klassischen Mikroskopiemethoden vor. Untersucht wurden Endothel-Zellsysteme in Collagen, die als Modellsystem für die Krebsforschung dienen. SPIM ermöglicht die Beobachtung von Wachstum, Wanderung und morphologischer Veränderungen großer Zellkomplexe mit sehr hoher Auflösung und verschwindend geringer Fototoxizität.
Am Max-Planck-Institut für Neurobiologie geht Dr. Klaus Dornmair der Frage nach, wie man autoaggressive Immunzellen, als Auslöser von Autoimmunkrankheiten wie Multiple Sklerose, von den normal arbeitenden T-Zellen unterscheiden kann. Mittels Laser-Mikrodissektion und Fluoreszenzdetektion werden angegriffene von gesunden Zellen isoliert und deren RNA verglichen. Um die Degradation der RNA zu verhindern, wurde das Verfahren beschleunigt, indem gleichzeitig mit zwei Fluoreszenzfarben und der Kernfärbung gearbeitet wird. Die gefundenen Differenzen werden anschließend isoliert und kloniert. Mit dieser äußerst scho-nenden Methode erhoffen sich die Forscher des MPI weit reichende Erkenntnisse über die Pathogenese bei MS und bei Autoimmunität allgemein.
Elke Haustein, aus dem Labor von Professor Schwille in Dresden, stellte anschließend neue Variationen der Fluoreszenzkorrelationsspektroskopie (FCS) vor. FCS liefert im Vergleich zu anderen Fluoreszenzverfahren genaue Informationen über die lokale Konzentra-tion von Biomolekülen, die Art und Geschwindigkeit der molekularen Bewegungen sowie über ihre Änderungen in der räumlichen Anord-nung. So erhält man beispielsweise wertvolle Informationen über DNA-Reparatur-Vorgänge nach UV-Schädigung. Erweitert durch das Konzept der Kreuzkorrelation (FCCS) untersucht die Biophysics Group das Bindungsverhalten von Proteinen. Man hat z.B. herausgefunden, dass die Komplexbildung zwischen den DNA-Reparatursystembestandteilen UVrA und UVrB im Verhältnis 2:1 stattfindet, also 'not two B'! Da sich das Verfahren FCCS für die genaue Untersuchung langsamer Bewegungen eignet, erhofft man sich neue Antworten auf die große noch offene Frage, wie es bei der Embryonalentwicklung zur Zellpolarisierung kommt.
An welcher Stelle im System Fluoreszenzmikroskop lässt sich noch eine Verbesserung der Auflösung erreichen? Heutige Detektoren sind am Limit, eine endgültige Auflösungsgrenze bei den Objektiven ist erreicht. Aber die Wechselwirkung der Farbstoffe ist noch eine veränderbare Einflussgröße, die sich STED zunutze macht. Durch stimulierte Emission wird hier eine deutliche Steigerung der Intensität erreicht, so dass die örtliche und zeitliche Verteilung von Molekülen in lebenden Zellen besser verfolgbar wird. Dr. Alexander Egner aus der Gruppe NanoBiophotonics von Professor Hell erläuterte einen neuen Ansatz der Anregung: Anstelle der bisher verwendeten gepulsten Laser, kommen jetzt sehr viel einfachere CW-Lichtquellen zum Einsatz. Diese haben den großen Vorteil, dass der Einsatz aufwändiger Elektronik entfällt und das Bleichen deutlich reduziert werden kann.
Eine zweite Erweiterung des STED-Konzeptes besteht in der Kombination mit dem so genannten 4Pi-Verfahren. Damit wird die Auflösung nicht nur in lateraler Ebene, sondern auch axial verbessert - 50nm in 3D! Mit dieser Technik kann z.B. die mitochondriale Proteinver-teilung in Prozessen der Matrixfaltung oder der Clusterbildung von ATP-Synthase in den Crystae beobachtet werden.