Der Zelle auf die Füße geschaut
Forscher des Helmholtz-Zentrums entwickeln neue Analysemethode der Zellbewegung
Wie Zellen sich bewegen, verraten FRAP und FLIP: Dabei handelt es sich aber nicht um Figuren aus einer Zeichentrickserie für Kinder, sondern um komplizierte Mikroskopietechniken, mit denen Dynamik und Umsatz von Proteinen in einer Zelle verfolgt werden können. Forscher des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI) haben mit diesen Methoden - gemeinsam mit Kollegen aus dem King's College in London und der Österreichischen Akademie der Wissenschaften - einen tiefen Einblick in die Mechanismen bekommen, mit denen Zellen sich bewegen. Dabei machten sie grundlegende Entdeckungen über die Veränderungen des Zellskeletts bei deren Wanderung.
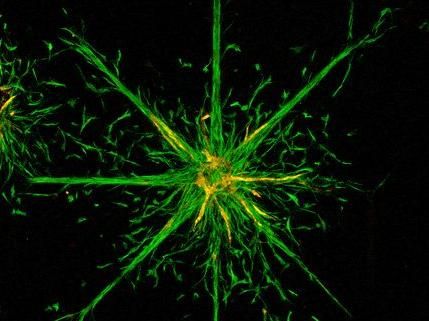
Die Zellen unseres Körpers sind nicht starr, sondern äußerst beweglich. Sie wandern während der Embryonalentwicklung zu ihren Bestimmungsorten oder bei einer Immunantwort zur Infektionsstelle. Krebszellen breiten sich im Körper aus, Wunden schließen sich durch Zellbewegung. Damit eine Zelle auf Wanderschaft gehen kann, stülpt sie einen Teil ihrer Zelloberfläche nach außen, ein so genanntes Lamellipodium. Auf diese Weise breitet sich die Zelle in die Richtung aus, in die sie sich bewegen möchte. Über Verankerungsproteine hält sie sich dann am Untergrund fest und zieht den Rest der Zelle ein Stück nach. Eine entscheidende Rolle bei der Zellbewegung spielt das Zellskelett - ein äußerst dynamisches Netzwerk von Proteinen, welches fadenförmige Molekülketten bildet, die der Zelle ihre Form geben und sie stabilisieren.
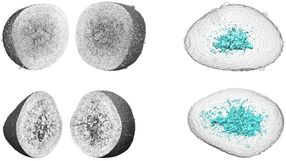
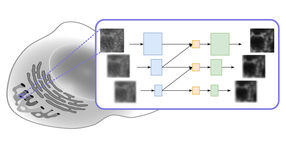
Bisher war unbekannt, wo genau diese Zellskelett-Filamente gebildet und verlängert werden - im gesamten Lamellipodium oder nur an vorderster Front und wie dieser Prozess molekular reguliert wird. Um das zu untersuchen, verwendeten die HZI-Forscher um Klemens Rottner Mikroskopiemethoden, die man als FRAP und FLIP bezeichnet. Dazu bringen die Forscher zunächst mit einem Farbstoff markierte Filament-Proteine sowie deren Regulatoren in die Zelle ein: Das Zellskelett erscheint im Mikroskop. Anschließend bleicht man mit einem Laser einen genau umgrenzten Bereich im Lamellipodium aus, der Farbstoff verblasst daraufhin und der Bereich wird schwarz. Da im Rest der Zelle noch viel farbiges Protein vorhanden ist und das Zellskelett sehr dynamisch ist, füllt sich der ausgeblichene Bereich langsam wieder mit Farbe. Diese Wiederherstellung der farbigen Zellskelettstrukturen wird anschließend analysiert und ermöglicht zu klären, wo und wie das Filament-Netzwerk des Lamellipodiums aufgebaut wird. Ein neu entwickeltes Ausleseverfahren der erhobenen optischen Daten sowie ein mathematisches Modell der Filamentneubildung im Lamellipodium vervollständigen diese Arbeit.
"Mit dieser Methode haben wir einen neuen Standard in der Analyse der Komponenten des Zellskeletts gesetzt", erklärt Rottner. "Sie ist ein wichtiger Beitrag zum Verständnis der molekularen Mechanismen, die an der Bewegung von Zellen beteiligt sind." Aber auch für die Infektionsforschung seien diese Erkenntnisse wichtig, da die Prozesse auch Krankheitserreger nutzten, um Zellen zu infizieren.
Originalveröffentlichung: FPL Lai, M Szczodrak, J Block, J Faix, D Breitsprecher, HG Mannherz, TEB Stradal, GA Dunn, JV Small, K Rottner; "Arp2/3 complex interactions and actin network turnover in lamellipodia."; Embo J. 2008 Apr 9; 982-992.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.


![[Fe]-Hydrogenase-Katalyse mittels Parawasserstoff-verstärkter Kernmagnetresonanzspektroskopie sichtbar gemacht](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-xl)