Gläsern statt glänzend
Bei extrem hohem Druck hört Natrium auf ein Metall zu sein und wird transparent
Durchblick durch ein Metall haben sich Wissenschaftler des Max-Planck-Instituts für Chemie verschafft. In einer internationalen Kooperation haben sie Natrium, das unter normalen Bedingungen weich ist wie ein Karamel-Toffee und silbrig schimmert, unter extremen Druck gesetzt. Bei zwei Millionen Bar schrumpfte das Natrium auf ein Fünftel seiner ursprünglichen Größe und wurde durchsichtig wie gelbliches Glas. Dabei verliert es vermutlich aber nicht nur seinen Glanz, sondern auch seine anderen metallischen Eigenschaften - dafür sprechen zumindest die Ergebnisse von Berechnungen, die Partner in der Kooperation machten: Demnach sollte Natrium keinen Strom mehr leiten und auch nicht mehr weich sein. Somit gilt es bei diesem hohen Druck nicht mehr als Metall. Das überrascht die Forscher, weil sie bislang angenommen haben, dass etwa die Leitfähigkeit unter erhöhtem Druck zunimmt. Doch das gilt offenbar nur, solange der Druck nicht über ein gewisses Maß steigt.
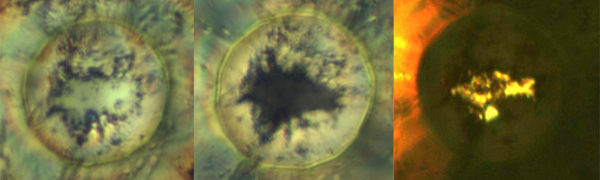
Unter extrem steigendem Druck verändert Natrium seine Erscheinung. Bei Atmosphärendruck glänzt es silbrig (links), färbt sich bei knapp einer Million Bar schwarz (Mitte), um bei zwei Millionen Bar schließlich transparent wie gelbes Glas zu werden. Der Farbwechsel ist jeweils Zentrum der drei Bilder zu erkennen, die durch die Versuchapparatur hindurch aufgenommen wurden.
Max-Planck-Institut für Chemie
Im Eisenkern der Erde herrscht ein Druck drei Millionen Bar. Im Inneren großer Gasplaneten ebenso wie in den äußeren Schalen von Sternen erreicht der Druck rund zwei Millionen Bar und im Inneren der Sonne liegt er noch um ein vielfaches darüber. Unter der Last einiger Millionen Bar verhält sich Materie ganz anders als unter dem sanften Druck der Atmosphäre. Und sie sieht auch ganz anders aus, wie Mikhail Eremets, Ivan Trojan und Sergey Mevedev in ihren Experimenten am Mainzer Max-Planck-Institut festgestellt haben.
Natrium im Schraubstock
Die Forscher spannten einen kleinen Natrium-Quader zwischen zwei Miniatur-Stempel aus Diamant und drückten diese wie einen Schraubstock zusammen. Durch den Diamanten beobachteten die Wissenschaftler, wie das Natrium-Stück sich bei knapp einer Million Bar schwarz färbte und bei rund zwei Millionen Bar transparent wie ein gelbliches Glas wurde. Sobald die Forscher das Natrium entlasteten, begann es wieder zu schimmern und kam als Metall wieder aus der Apparatur heraus. Das Natrium änderte seine Erscheinung also nicht, weil es mit anderen Stoffen, etwa Luftsauerstoff oder Wasser, chemisch reagierte. Dabei verliert Natrium nämlich auch seinen Glanz und die anderen metallischen Charakteristika.
"Schon die kleinste Verunreinigung hätte unsere Experimente daher unbrauchbar gemacht", sagt Mikhail Eremets: "Entsprechend schwierig sind die Versuche." Die Forscher arbeiten in einem Glaskasten, der mit reinem Stickstoff gefüllt ist und in den sie mit derben Gummihandschuhen hineingreifen. Das erleichtert die diffizilen Druckversuche nicht gerade. Sie müssen nämlich einen Natriumquader präparieren, dessen beiden längeren Kanten gerade mal 30 Mikrometer messen.
Größer darf das Natriumstück jedoch nicht sein. Denn nur auf einer sehr kleinen Fläche lassen sich mit einer einigermaßen handlichen Apparatur zwei Millionen Bar erzeugen. Erschwert wurden die Experimente, weil selbst Diamant zwei Millionen Bar nicht stand hält: Bei so einem Druck werden gewöhnlich Natriumatome in den Edelstein gepresst und sprengen ihn. "Um das zu verhindern, müssen wir die Oberfläche sorgfältig strukturieren", erklärt Eremets.
Rechnungen liefern eine Erklärung
Sobald sie das Natrium zwischen den Diamant-Stempeln dann in den Schraubgriff nehmen, durchleuchten sie es auch noch mit verschieden spektroskopischen Methoden. Unter anderem untersuchten sie das gequetschte Metall mit einem Synchrotronstrahl - zusammen mit Vitali Prakapenka an der Advanced Photon Source des Argonne National Labors in den USA. Auf diese Weise erhielten sie Hinweise, wie sich das Natrium unter zunehmendem Druck verändert.
Eine genauere Erklärung für die experimentellen Ergebnisse liefern aber nur Rechnungen, die Yanming Ma von der Jilin Universität in China zusammen mit Artem Oganov von der US-amerikanischen Stony Brook Universität anstellten. Sie hatten vorhergesagt, dass Natrium unter extremem Druck außergewöhnliche Kristallstrukturen bildet, und hatten mit dieser Prognose die Experimente überhaupt erst angestoßen.
Unter Normalbedingungen bildet Natrium eine Struktur, die Kristallografen als kubisch-innenzentriert bezeichnen. Das heißt die Elementarzelle des Natriums besteht aus einem Würfel, an dessen Ecken jeweils ein Atom sitzt. Ein weiteres steckt im Inneren des Kubus. Ein solides Stück Natrium ergibt sich, indem man in allen Raumrichtungen die Elementarzellen aneinander reiht.
Druck sorgt für atomare Drängelei
Bei Atmosphärendruck sind die Kanten der Elementarzelle gut vier Millionstel Millimeter lang. Unter zwei Millionen Bar schrumpft sie nicht nur deutlich, in ihr müssen dann sogar 14 statt 9 Atomen Platz finden. "Sie rücken dabei so dicht zusammen, dass ihre Rümpfe überlappen", sagt Eremets. Atomrumpf heißt der Atomkern mit dem Teil der Elektronen, die chemisch kaum eine Rolle spielen. Gewöhnlich überlappen Atome nur mit ihrer äußeren Hülle, also einem kleinen Teil ihrer Elektronen - egal ob sie Moleküle oder Kristalle bilden, zu denen auch ein Stück reines Metall gehört. Und solange nur diese äußere Hülle betroffen ist, gilt: Je besser die Atome in einem Metall überlappen, desto besser leiten sie Strom. Denn eine engere Verbindung zwischen den Atomen macht die Elektronen beweglicher.
Bei zwei Millionen Bar ist das aber anders. Dann drängeln sich die Atome so dicht, dass die Elektronen jede Bewegungsfreiheit verlieren. Diese Bewegungsfreiheit schafft auch den metallischen Glanz - die Elektronen nehmen sichtbares Licht auf und setzen es, vereinfacht gesprochen, in Bewegung um, ehe sie es wieder abgeben und den Schimmer erzeugen. Eingezwängt, wie sie unter extremem Druck sind, fehlt ihnen aber fast für jegliche Bewegung der Platz. Das Licht dringt ungehindert durch sie hindurch.
"Die äußeren Elektronen sind dabei so stark lokalisiert, dass sie wie Anionen in dem Gitter der Atomrümpfe sitzen", sagt Mikhail Eremets. Natrium wird also zu einer Art Salz, in dem nicht negativ geladene Ionen, sondern in Kugeln gepresste Elektronen, die Gegenstücke zu den positiven Ionen bilden. Natrium ähnelt dann Materialien, die Elektride heißen und erst vor wenigen Jahren entdeckt wurden. Über ihre Eigenschaften ist noch nicht viel bekannt. "Gewöhnlich handelt es sich dabei um sehr komplexe Verbindungen", sagt Eremets: "Wir haben jetzt ein sehr einfaches Modell geschaffen, um diese außergewöhnliche Materie genauer zu untersuchen."
Originalveröffentlichung: Yanming Ma et al.; "Transparent dense Sodium"; Nature, 12. März 2009