So sieht Botox aus: Forscher entschlüsseln Funktion und komplizierte Raumstruktur des Neurotoxins
MHH-Forscher fanden heraus, wie der Botulinum-Komplex unbeschadet ins Blut gelangt
Wissenschaftler der Medizinischen Hochschule Hannover (MHH) haben zusammen mit amerikanischen Kollegen aufgeklärt, wie das Bakterium Clostridium botulinum sein Nervengift in das Blut des Menschen schleust. Das Team um Dr. Andreas Rummel vom Institut für Toxikologie veröffentlichte gemeinsam mit Professor Rongsheng Jin, University of California, Irvine, Kalifornien seine Ergebnisse in PLOS Pathogens.
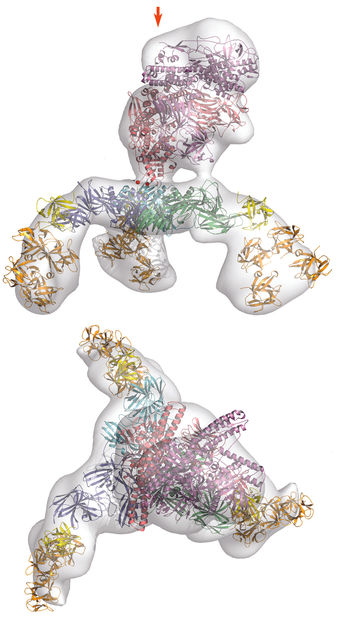
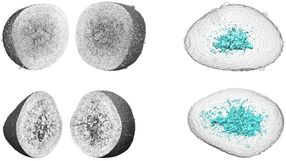
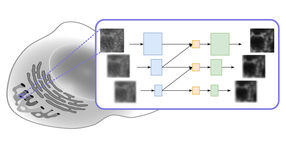
Raumstruktur des Botulinum-Komplexes.
Rummel/MHH
Mit Botulinumtoxin werden schwere Bewegungsstörungen erfolgreich behandelt – als „Botox“ spielt es bei kosmetischer Faltenglättung eine bekannte Rolle. Wie aber der Wirkstoff des bereits 1989 als Arzneimittel für seltene Leiden (orphan drug) zugelassenen Medikaments aussieht, war bis dato unbekannt. Ursprünglich bekannt wurde das Botulinum-Toxin durch die heutzutage seltene Krankheit Botulismus, eine tödliche Lebensmittelvergiftungen. Dabei gelangt dieses hochmolekulare Eiweiß ins Blut. „Vergangenes Jahr konnten wir aufklären, wie ein Schutzprotein das Toxin einpackt und so gegen das feindliche Milieu in Magen und Dünndarm beschützt,“ sagt Dr. Rummel, „jetzt verstehen wir auch, wie es an der Dünndarmwand andockt und das Toxin in die Blutbahn entlässt“. Dr. Rummel und seine Mitarbeiterinnen Anna Magdalena Kruel, Thi Tuc Nghi Le, Jasmin Strotmeier und Nadja Krez fanden heraus, dass sich dazu drei weitere Proteine zu einem zwölfteiligen Subkomplex zusammenlagern. „Die Struktur erinnert entfernt an das Mondlandemodul der Apollo-Mission“, erklärt Dr. Rummel. Dieser sogenannte HA-Komplex bindet über bis zu neun Kontaktpunkte an Zucker auf der Oberfläche des Dünndarmepithels und öffnet anschließend Zell-Zell-Kontakte, um das Toxin effizient in die Blutbahn gelangen zu lassen.
Den Wissenschaftlern gelang es mit Hilfe von Elektronenmikroskopie und Röntgenstrukturanalysen die Raumstruktur des 14-teiligen Komplexes aufzuklären, der aus mehr als 6500 Aminosäuren besteht. Zellbiologische Experimente konnten die funktionelle Rolle der einzelnen Bestandteile ermitteln. Die Erkenntnis der Bindung an Zuckermoleküle erlaubte es den Forschern, Substanzen in Mäusen erfolgreich zu testen, die die Resorption des Toxins verhindern. „Dies ist eine völlig neue Therapiestrategie gegen Botulismus, die im Falle einer bioterroristischen Bedrohung mit dem Botulinum-Neurotoxin auch präventiv eingesetzt werden könnte“ erläutert Dr. Rummel.
Originalveröffentlichung
Kwangkook Lee, Shenyan Gu, Lei Jin, Thi Tuc Nghi Le, Luisa W. Cheng, Jasmin Strotmeier, Anna Magdalena Kruel, Guorui Yao, Kay Perry, Andreas Rummel and Rongsheng Jin, "Structure of a bimodular botulinum neurotoxin complex provides insight into its oral toxicity"; PLOS Pathogens
Meistgelesene News
Originalveröffentlichung
Kwangkook Lee, Shenyan Gu, Lei Jin, Thi Tuc Nghi Le, Luisa W. Cheng, Jasmin Strotmeier, Anna Magdalena Kruel, Guorui Yao, Kay Perry, Andreas Rummel and Rongsheng Jin, "Structure of a bimodular botulinum neurotoxin complex provides insight into its oral toxicity"; PLOS Pathogens
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.


![[Fe]-Hydrogenase-Katalyse mittels Parawasserstoff-verstärkter Kernmagnetresonanzspektroskopie sichtbar gemacht](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-xl)