Das Zellskelett des Malaria-Erregers unter dem Supermikroskop
Erster Schritt zu maßgeschneiderten Medikamenten gegen Infektionskrankheit
Die Tropenkrankheit Malaria wird durch den Parasiten Plasmodium verursacht. Für das Überleben und die Verbreitung der Plasmodien spielt das Protein Aktin eine wichtige Rolle. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) haben hochauflösende Methoden der Strukturbiologie angewendet, um die verschiedenen Versionen dieses Proteins in dem Parasiten genauer zu untersuchen. Ihre in der Zeitschrift „PLOS Pathogens“ veröffentlichten Ergebnisse könnten zukünftig dazu beitragen, maßgeschneiderte Medikamente gegen Malaria zu entwickeln – einer Krankheit, die jährlich über eine halbe Million Opfer fordert.
Malaria ist eine lebensbedrohliche Infektionskrankheit. Die Weltgesundheitsorganisation schätzt, dass es im Jahr 2012 rund 207 Millionen Malariaerkrankte gab; am häufigsten trifft es Kinder in Afrika. Eine zugelassene Impfung gibt es bislang nicht. Die Krankheit wird durch Plasmodien verursacht – einzellige Parasiten, die von Moskitos übertragen werden. Durch einen Stich gelangen die Erreger in den Menschen und rufen dort typische Symptome wie periodisch auftretendes Fieber, Übelkeit und Kopfschmerzen.
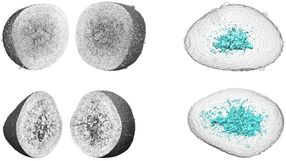
Damit Plasmodien in menschliche Zellen eindringen und sie wieder verlassen können, müssen sie beweglich sein. Dazu nutzen sie ein Strukturprotein namens Aktin. Aktin kommt in fast allen Lebewesen vor und ist dort eines der häufigsten Proteine. In der Zelle übernimmt es viele Aufgaben: Es verleiht ihnen Stabilität, ermöglicht Zellteilung und sorgt auch dafür, dass sich einzelne Zellen fortbewegen können. Das dynamische Verhalten, das für diese Vorgänge notwendig ist, kommt dadurch zustande, dass sich einzelne kugelförmige Aktin-Moleküle zu fadenähnlichen Strukturen, sogenannten Filamenten, zusammenschließen können. Der Malaria-Erreger besitzt zwei Versionen, Aktin I und Aktin II, die sich stark voneinander unterscheiden. Obwohl diese Strukturproteine so wichtig für die Infektiosität des Erregers sind, konnten Wissenschaftler bis heute keine Filamentbildung in Plasmodien nachweisen.
Wissenschaftlern des HZI, des Deutschen Elektronen-Synchrotrons (DESY) und des European Molecular Biology Laboratory (EMBL) gelang es nun gemeinsam mit internationalen Partnern, die Aneinanderreihung von Aktin II-Proteinen des Parasiten zu Filamenten zu beobachten. Dazu nutzten sie Elektronenmikroskopie, die die Auflösungsgrenze der klassischen Lichtmikroskopie überwindet. Männliche Malaria-Erreger, in denen die Forscher Aktin II ausgeschaltet hatten, konnten keine reifen Keimzellen mehr bilden und sich folglich nicht fortpflanzen und verbreiten. Nur eine Aktin-Variante zu besitzen, reicht hierfür offenbar nicht aus. Welche Rolle die Filamente bei der Keimzellreifung spielen, ist nach wie vor unklar. Doch warum verhalten sich die beiden Proteine so unterschiedlich?
Um diese Frage zu beantworten, entschlüsselte das Forscherteam den Aufbau der kugelförmigen Proteine mithilfe von Röntgenstrahlen. „Wir konnten die Strukturen von Aktin I und Aktin II mit sehr hoher Auflösung bestimmen – bis auf 1,3 bzw. 2,2 Ångström. Damit befinden wir uns in der Größenordnung von einzelnen Atomen“, sagt Projektleiterin Prof. Inari Kursula. „So haben wir festgestellt, dass sich beide Varianten mehr unterscheiden als es in anderen Lebewesen je beobachtet wurde.“ In dieser hohen Auflösung konnten die Forscher Proteinbereiche identifizieren, die das unterschiedliche Verhalten hervorrufen. „Wir verstehen jetzt, dass sich die Aktin-Filamente der Plasmodien stark von anderen Aktin-Filamenten, beispielsweise denen des Menschen, unterscheiden und dass sie auf völlig andere Weise aufgebaut werden als diese. Da wir nun die strukturelle Basis dafür kennen, können wir nach Wegen suchen, das Zellskelett des Parasiten gezielt zu beeinflussen“, sagt Kursula. Dieses Wissen könnte in Zukunft dazu beitragen, maßgeschneiderte Malaria-Medikamente zu entwerfen.
Originalveröffentlichung
Juha Vahokoski, Saligram Prabhakar Bhargav, et al., Structural Differences Explain Diverse Functions of Plasmodium Actins PLOS Pathogens, 2014
Meistgelesene News
Originalveröffentlichung
Juha Vahokoski, Saligram Prabhakar Bhargav, et al., Structural Differences Explain Diverse Functions of Plasmodium Actins PLOS Pathogens, 2014
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.


![[Fe]-Hydrogenase-Katalyse mittels Parawasserstoff-verstärkter Kernmagnetresonanzspektroskopie sichtbar gemacht](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-xl)