Wie Zellen ihre Form verändern
Die Rolle des Proteins „Smallish“ bei der Gestaltbildung des Embryos
Damit sich aus der befruchteten Eizelle ein vollständiger Organismus mit der für seine Art typischen Gestalt entwickelt, muss die Form vieler Zellen in koordinierter Weise verändert werden. Forscherinnen und Forscher des Exzellenzclusters für Alternsforschung CECAD in Köln haben ein Gen identifiziert, welches für die Formgebung von Zellen zuständig ist.
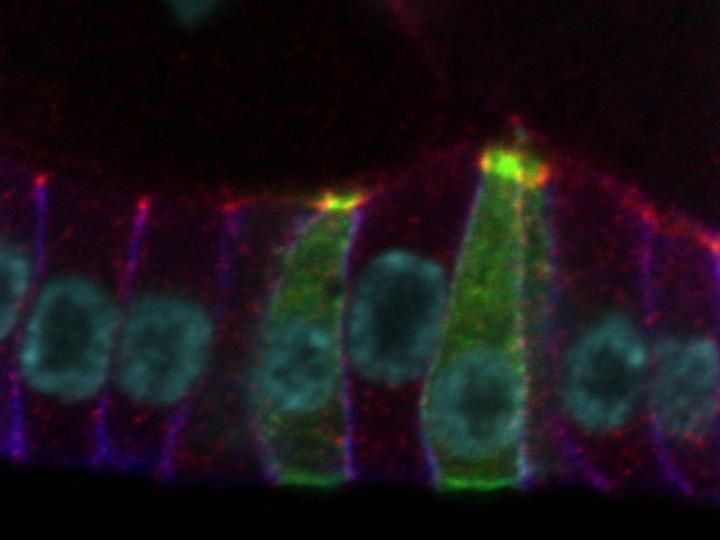
Das Protein Smallish (grün) wurde in einzelnen Zellen der Taufliege Drosophila in stark erhöhter Menge hergestellt. Infolgedessen ziehen sich die Zellen am oberen Ende zusammen, sodass sie in der Seitenansicht wie schlanke Dreiecke aussehen. Das Bild wurde mit einem Zeiss LSM 880 Konfokalmikroskop mit Airyscan Detektor im Institut für Anatomie der Uniklinik Köln aufgenommen.
Irina Peek & Andreas Wodarz
Während der Entwicklung des Embryos muss jede einzelne Zelle wissen, wer sie ist, wo sie ist und was sie zu tun hat. Wichtig ist dabei die Polarität der Zelle: Wo ist oben, wo ist unten, wo vorne und hinten? Nur wenn die Zelle entsprechend polarisiert ist, kann sie ihre Form in genau der Weise verändern, die für die Bildung einer bestimmten Struktur oder eines Organs notwendig ist.
Gesteuert wird die Polarität der Zellen von einer relativ kleinen Gruppe von Proteinen, die in allen höheren Tieren über Jahrmillionen fast unverändert geblieben sind. „Vor fast 20 Jahren entdeckte mein erster Doktorand Andreas Ramrath ein interessantes, zunächst namenloses Gen, von dem wir annahmen, dass es an der Steuerung der Polarität beteiligt sein könnte“ berichtet Professor Dr. Andreas Wodarz, Institut I für Anatomie an der Uniklinik Köln.
Die ersten Versuche liefen vielversprechend – obwohl sich das Gen als sehr wandelbar erwies. Zunächst schien das Gen die Information für ein mittelgroßes Protein von etwa 900 Aminosäuren zu kodieren. Doch nach und nach wurde klar, dass das Gen in Wirklichkeit deutlich größer ist und die Information für ein fast doppelt so großes Protein enthält. Schließlich gelang es, das Gen in der Taufliege Drosophila auszuschalten, aber überraschenderweise waren die mutanten Tiere lebensfähig. „Die meisten für Polarität wichtigen Gene sind essenziell und Organismen können ohne diese nicht leben. Weil das Ergebnis zunächst nicht unseren Erwartungen entsprach, landete das Gen erstmal in der Schublade,“ erklärt Prof. Wodarz weiter. Erste Hinweise auf die Funktion des Gens erbrachten fast zehn Jahre später Experimente des zweiten mit dem Projekt befassten Doktoranden Hamze Beati. Er stellte einen transgenen Fliegenstamm her, der es erlaubte, in einzelnen Zellen des Körpers einen großen Überschuss dieses Proteins zu bilden. Das Resultat war verblüffend: Die Zellen veränderten ihre Form und zogen sich am oberen Rand zusammen. Von oben betrachtet, sehen die Zellen deutlich kleiner aus, was dem Gen den Namen „Smallish“ einbrachte: Hier ergab sich ein offensichtlicher Widerspruch: Einerseits hatte Smallish einen großen Einfluss auf die Form der Zellen, aber dennoch konnten mutante Fliegen ohne Smallish überleben.
Irina Peek, der dritten Doktorandin und Ko-Erstautorin der jetzt erschienenen Veröffentlichung, gelang 2016 der Durchbruch. Sie fand den Grund, warum die Fliegen mit ausgeschaltetem Gen lebensfähig waren: Er bestand in der Einlagerung des funktionsfähigen Smallish-Proteins in der Eizelle. In smallish mutanten Embryonen, deren Mütter schon mutant waren und daher das Protein nicht in die Eizelle einlagern konnten, lief die Gestaltbildung völlig aus dem Ruder. „Smallish ist wichtig für die korrekte Form der Zellen. In Embryonen, denen Smallish vollständig fehlt, sehen wir, dass die Zellen schlaff sind, keine Spannung mehr haben,“ so Irina Peek. "Solche Zellen sind dann nicht in der Lage, die koordinierten Zellformveränderungen durchzuführen, die für die normale Gestaltbildung essentiell sind."
Interessant ist das Gen nicht nur für die Grundlagenforschung. „Das Gen ist evolutionär hoch konserviert, kommt also in ähnlicher Form in vielen Lebewesen vor. Das menschliche Homolog LMO7 ist als Tumorsuppressor bekannt. In einer Reihe von Tumoren konnte gezeigt werden, dass die Menge von LMO7 reduziert ist, was auf eine Funktion in der Wachstumskontrolle hindeutet,“ ergänzt Prof. Wodarz. In weiteren Experimenten soll jetzt untersucht werden, wie genau „Smallish“ mit anderen Proteinen interagiert, wie es an seinen Wirkungsort in der Zelle gelangt und wie es die Form der Zellen beeinflusst.
Originalveröffentlichung
Beati, Hamze and Peek, Irina and Hordowska, Paulina and Honemann-Capito, Mona and Glashauser, Jade and Renschler, Fabian A. and Kakanj, Parisa and Ramrath, Andreas and Leptin, Maria and Luschnig, Stefan and Wiesner, Silke and Wodarz, Andreas; "The adherens junction–associated LIM domain protein Smallish regulates epithelial morphogenesis"; J Cell Biol; 2018




















![[Fe]-Hydrogenase-Katalyse mittels Parawasserstoff-verstärkter Kernmagnetresonanzspektroskopie sichtbar gemacht](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-xl)



































