Chemiker aus Innsbruck und New York beobachten einzelne Schaltermoleküle in Aktion
Bakterien sind uns Menschen in mancherlei Hinsicht voraus. Zum Beispiel verfügen sie über „intelligente“ RNA-Moleküle, sogenannte Riboschalter, mit denen sie viele ihrer lebenswichtigen Stoffwechselvorgänge steuern. Die erst vor wenigen Jahren entdeckten Riboschalter sind Sensor und Schalter in einem RNA-Molekül. Ein Riboschalter funktioniert ganz ähnlich wie ein Bewegungsmelder, der das Licht ein- oder ausschaltet, wenn Personen in der Nähe sind: Der Riboschalter schaltet Gene ein- oder aus, wenn bestimmte Stoffwechselprodukte vorhanden sind. Weil es diese Art der Genregulation beim Menschen nicht gibt, stellt sie ein ideales Angriffsziel für neue Antibiotika da.
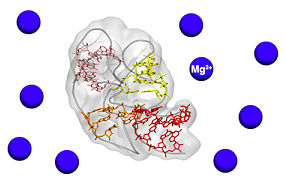
Wie der Sensor- und Schaltvorgang genau abläuft, lag bisher weitgehend im Dunkeln. Nun ist es einem internationalen Team unter der Führung von Innsbrucker Chemikern gelungen, dem S-Adenosylmethionin (SAM) II-Riboschalter in Aktion zuzusehen. SAM ist ein Cofaktor, der in viele Stoffwechselprozesse involviert ist, indem er Methylgruppen überträgt.
Moleküle sind zappelig
Die Wissenschaftler Andrea Haller und Ronald Micura vom Institut für Organische Chemie und dem Centrum für Molekulare Biowissenschaften der Universität Innsbruck haben gemeinsam mit Scott Blanchard vom Weill Cornell Medical College in New York mit einer Technik namens smFRET (single-molecule Fluorescence Resonance Energy Transfer) die Bewegungen einzelner Riboschalter-Moleküle aufgezeichnet. Die Wissenschaftler haben entdeckt, dass SAM II-Riboschalter äußerst „zappelige“ Moleküle sind, die ihre Struktur immens schnell ändern. „Der Schlüssel zum Verständnis ihrer Funktion liegt genau in dieser Dynamik“, erklärt Micura. Die Arbeit seines Teams fand im Rahmen des GEN-AU-Projekts zu nichtkodierenden RNAs statt, das von der Innsbrucker Firma CEMIT gemanagt wird, und wurde auch vomWissenschaftsfonds FWFgefördert.
Umschalten wird ständig simuliert
Der SAM II-Riboschalter schaltet auf Aus, wenn ein SAM-Molekül an ihn bindet. Dann nimmt er eine Struktur ein, in der die genetische Information nicht mehr zugänglich ist. Mit Hilfe der smFRET-Technik und begleitet von anderen Untersuchungen konnte das Team um Micura erstmals detailliert analysieren, was vor und während der Bindung passiert. Wie erwartet sahen sie, dass der freie Riboschalter zunächst eine offene Struktur hat, in der die genetische Information leicht zugänglich ist. Aber nicht nur das: Selbst wenn noch gar kein SAM-Molekül in der Nähe ist, simuliert der Riboschalter bereits ständig das Umschalten. Er pendelt im Mikrosekundentakt zwischen der offenen Struktur und einem weiteren Zustand hin und her, der dem Aus-Zustand schon sehr ähnlich ist. Taucht ein SAM-Molekül auf, bindet es an den „Fast-schon-Aus-Zustand“, eine minimale Strukturänderung erfolgt und dann ist der Schalter wirklich aus. Diese Struktur ist dann fixiert.
Einzelne Moleküle eröffnen eine neue Dimension der Forschung
Micura und sein Team sind von dieser Entdeckung begeistert. Gerade im Jahr der Chemie wird immer deutlicher, dass dies keineswegs eine entzauberte Wissenschaft ist, deren Rätsel längst gelöst sind. Ganz im Gegenteil: Früher basierte Wissen zumeist auf Durchschnittswerten, die an einer großen Anzahl von Molekülen gleichzeitig gemessen wurden. Heute ist es technisch möglich, einzelne Moleküle zu beobachten und ihr individuelles Verhalten erkennbar zu machen. „Das ist eine ganze neue Dimension der Forschung und unheimlich spannend“, so Micura.
Hintergrund Riboschalter
Riboschalter liegen auf der messenger RNA (mRNA), die den Gencode für ein Protein transportiert. Sie selbst kodieren allerdings nicht für eine Proteinsequenz. Riboschalter funktionieren, indem sie – bei Bindung ihres Zielmoleküls - die mRNA blockieren. Somit kann die genetische Information nicht weiterverarbeitet werden. Meist handelt es sich um jenes Gen, das für die Herstellung des Zielmoleküls verantwortlich ist. Auf diese Weise kommt es zu einer Rückkopplung: Wenn viel von dem Zielmolekül vorhanden ist, wird seine weitere Produktion gebremst.
Originalveröffentlichung
Haller et al. "Conformational capture of the SAM-II riboswitch", Nature chemical biology, Advance online publication
Originalveröffentlichung
Haller et al. "Conformational capture of the SAM-II riboswitch", Nature chemical biology, Advance online publication
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Ab sofort nichts mehr verpassen: Unser Newsletter für Analytik und Labortechnik bringt Sie jeden Dienstag auf den neuesten Stand. Aktuelle Branchen-News, Produkt-Highlights und Innovationen - kompakt und verständlich in Ihrem Posteingang. Von uns recherchiert, damit Sie es nicht tun müssen.