Anstandsdamen bei der Arbeit
Die korrekte Faltung von Proteinen (Eiweißen) in der Zelle ist unbedingt nötig, damit sie ihre natürliche dreidimensionale Struktur erhalten. Nur ein Protein, das "in Form" ist, kann auch seine Aufgaben in der Zelle erfüllen. Anstandsdamen - Chaperone - der Zelle sorgen dafür, dass Proteine die richtige 3D-Form bekommen oder bei Stress nicht dauerhaft verlieren. In menschlichen Zellen bilden Hsp70-Anstandsdamen und ihre Helfer eine zentrale "Faltungsmaschine".
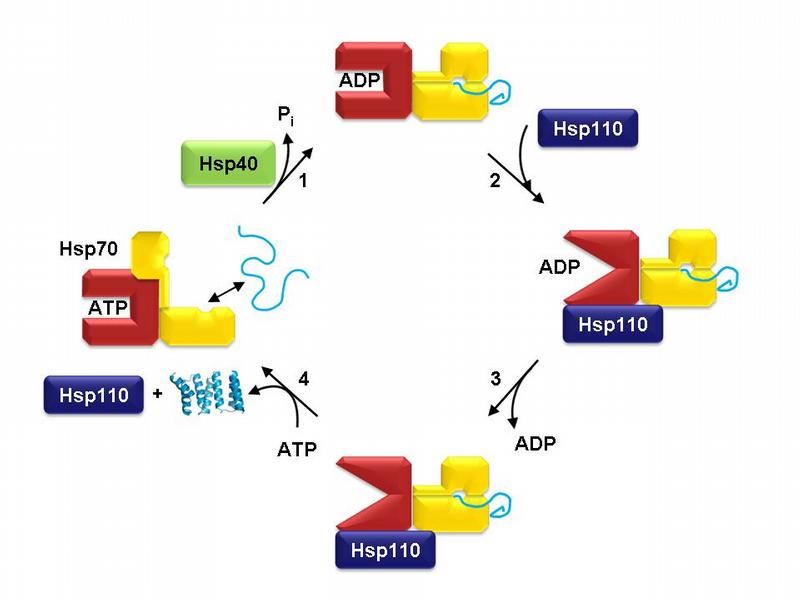
Der Proteinfaltungszyklus von Hsp70. Schematisch ist Hsp70 im ATP-gebundenen Zustand gezeigt (links). Die Nukleotidbindungsdomäne ist rot gefärbt, die Substratbindungsdomäne gelb. Hsp40 vermittelt die Bindung von Hsp70 an das ungefaltete Protein (hellblau) und hilft bei der Umsetzung von ATP zu ADP (Schritt 1). Der ADP-gebundene Zustand von Hsp70 wird von Hsp110 erkannt (Schritt 2), was zur Freisetzung von ADP führt (Schritt 3). Der Komplex zerfällt in seine Einzelteile und lässt das Proteinsubstrat zur Faltung frei, sobald ATP an Hsp70 bindet (Schritt 4). Hsp70 ist dann bereit für einen weiteren Faltungszyklus.
Max-Planck-Institut für Biochemie
Wissenschaftler des Max-Planck-Instituts für Biochemie in Martinsried bei München veröffentlichen in der aktuellen Ausgabe des Fachjournals Cell wichtige Ergebnisse zur Struktur der Hsp70-Faltungsmaschine und liefern damit neue Details zum Mechanismus der Proteinfaltung.
Die 3D-Struktur eines Proteins wird durch die Abfolge seiner Aminosäurebausteine festgelegt. Allerdings können meist nur kleine Proteine eigenständig ihre endgültige Struktur finden. Größere Proteine neigen dazu, während des spontanen Faltungsvorgangs in Sackgassen zu geraten und dann unkontrolliert zu verklumpen. Dieser Vorgang wird auch Aggregation genannt und in natürlichen Zellen durch die hohe Konzentration an großen Molekülen begünstigt. Eine Fehlsteuerung der Proteinfaltung ist auch eine Ursache für neurodegenerative Erkrankungen, wie die Alzheimer-Krankheit oder die Creutzfeldt-Jakob-Erkrankung. Hier schädigen die Protein-Aggregate - Plaques - das Nervengewebe.
Um eine Aggregation zu verhindern, besitzt die Zelle deshalb Anstandsdamen, die die Faltung der Proteine kontrollieren und dafür sorgen, dass richtige Molekülstrukturen gebildet werden und zueinander finden. Die Anstandsdamen, auch Chaperone genannt, werden in der Zelle verstärkt unter Hitze-Stress erzeugt. Daher werden sie auch als Hitzeschockproteine, abgekürzt Hsp, bezeichnet. Eines der häufigsten Hitzeschockproteine, Hsp70, hat sich während der Evolution in allen einzelligen und mehrzelligen Organismen in sehr ähnlicher Form erhalten und ist für die Zelle lebensnotwendig.
Das Hsp70-Molekül besteht aus zwei Einheiten (Domänen), die miteinander in Wechselwirkung stehen. An die eine Domäne können die Nukleotide ATP oder ADP (Adenosin-Triphosphat/Diphosphat) binden, die an den meisten Zellreaktionen beteiligt sind. Die zweite Domäne besitzt eine Bindestelle für ungefaltetes Protein.
Während Hsp70 im ATP-gebundenen Zustand das Protein schnell bindet und auch wieder loslässt, hält es das Protein im ADP-Zustand fest. Besondere Proteine, die die beiden Zustände ineinander überführen, helfen Hsp70 bei seinen Aufgaben: Hsp40-Proteine werden gebraucht, um ATP in ADP umzuwandeln und Hsp110-Proteine helfen, ADP von Hsp70 abzulösen und dieses damit für ein neues Protein zugänglich zu machen (s. Abb.). Sigrun Polier konnte in ihrer Doktorarbeit unter Anleitung von Andreas Bracher zeigen, wie Hsp110 genau arbeitet. Zunächst gelang den Martinsrieder Wissenschaftlern die schwierige Aufgabe, den gesamten Protein-Komplex mit Hsp70 und Hsp110 zu kristallisieren. Bei derartig großen Proteinen keine kleine Meisterleistung. Anschließend konnten Polier und Bracher mit Röntgenstrahlen die Struktur des Kristalls aufklären und durch biochemische Analysen ihre Ergebnisse absichern.
Die beiden Wissenschaftler arbeiten in der Forschungsabteilung Zelluläre Biochemie, die unter Leitung von Professor F.-Ulrich Hartl internationale Spitzenforschung auf dem Gebiet der Proteinfaltung leistet. Andreas Bracher kommentiert die außerordentlich erfolgreiche Arbeit der letzten Jahre: "Wir können jetzt endlich erklären, wie Hsp110 die ADP-Ablösung aus Hsp70 beschleunigt. In dem von uns jetzt gefundenen Komplex umarmt Hsp110 förmlich einen Arm der Nukleotidbindungsdomäne von Hsp70. Dadurch öffnet sich dessen Nukleotid-Bindungstasche, so dass sich das ADP ablösen kann. Die erneute Bindung von ATP an Hsp70 stellt dann den Startpunkt für einen neuen Faltungszyklus dar. Hsp110, das in Zellen aller höheren Organismen gefunden wurde, ist daher entscheidend für effiziente Faltungskatalyse durch die Hsp70 Maschine".
Originalpublikation: Polier, S., Dragovic, Z., Hartl, U. & Bracher, A.; "Structural basis for the cooperation of Hsp70 and Hsp110 chaperones in protein folding."; Cell 2008.




















![[Fe]-Hydrogenase-Katalyse mittels Parawasserstoff-verstärkter Kernmagnetresonanzspektroskopie sichtbar gemacht](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-xl)



































